BEACON碧康制药
由欧洲财团参与投资,南亚地区唯一执行欧盟技术规范的上市制药企业,产品符合欧洲药典和美国药典标准。
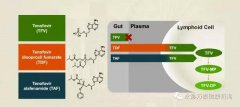
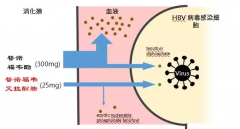
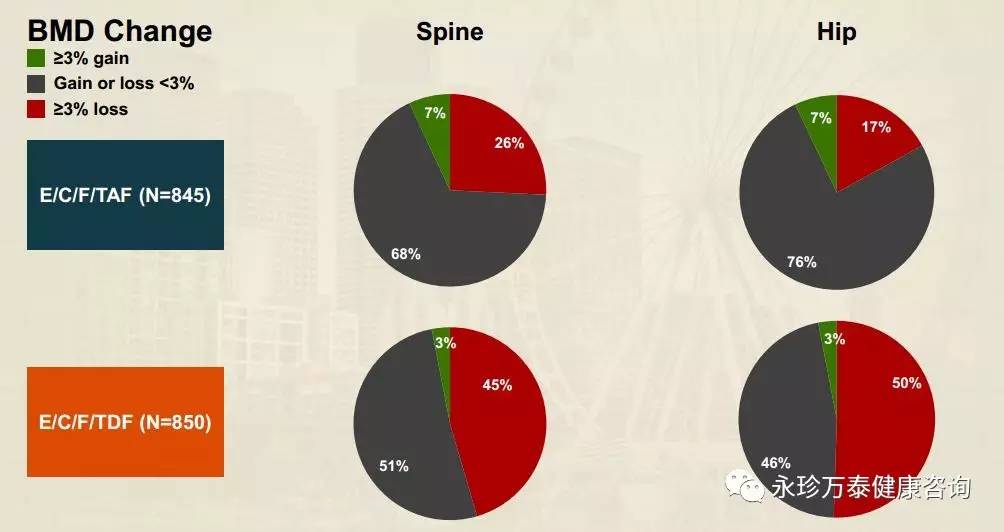
根据临床研究48周结果,TAF获FDA批准上市,用于治疗伴有代偿性肝病的慢性乙肝病毒(HBV)感染患者。TAF 25mg在降低HBV病毒载量方面的疗效不劣于TDF300mg,且相比TDF,TAF可显著改善患者的骨骼、肾脏实验室参数,ALT水平恢复正常的患者比例更高。
国际肝病会议(ILC)2017大会上公布的数据显示,TAF用药96周,可保持较高的病毒抑制率,没有发现耐药,而且对肾功能和骨密度参数的影响更小(#PS-042, #FRI-153)。另外,从TDF换用TAF治疗96周后,患者仍保持病毒学抑制,血清ALT水平恢复正常,肾功能和骨密度参数在换药24周后即得到改善。 (#PS-041: “Hepatitis B and D: emergingtreatment options”)。
具体结果如下:
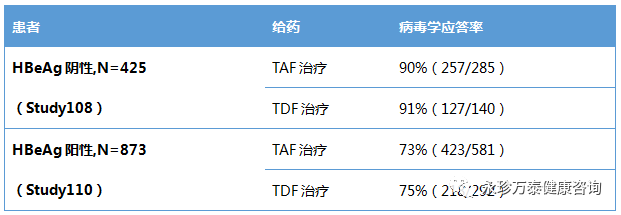
在对Study 108 和Study 110研究中完成96周治疗的541例患者进行事后分析时发现,在由TDF换用TAF的180例患者中,在第96周时能够保持病毒学抑制,并且在换药24周后ALT水平即恢复正常。
总结
TAF是治疗伴有代偿性肝病的慢性乙肝病毒(HBV)感染患者的抗病毒强效药,相比于TDF有更好的骨骼安全性和肾脏安全性,治疗96周时没有出现耐药情况,先前用TDF治疗的患者换用TAF后仍可保持良好的病毒学抑制效果。
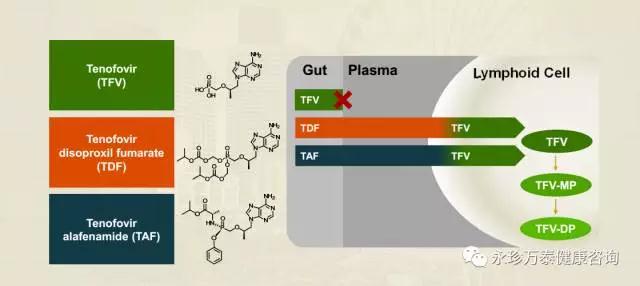
HBV/HIV合并感染人群,91%的血浆TFV(替诺福韦)水平降低了对肾脏和骨骼的副作用影响,同时保持高效能抑制HIV病毒