BEACON碧康制药
由欧洲财团参与投资,南亚地区唯一执行欧盟技术规范的上市制药企业,产品符合欧洲药典和美国药典标准。
前言
2019年7月23日,Merck和Eisai收到美国FDA关于KEYTRUDA? (pembrolizumab) +LENVIMA? (lenvatinib)联合使用的第三个突破性疗法(Breakthrough Therapy Designation BTD)认证。这一突破性疗法授予的指征是仑伐替尼+K药用于一线治疗晚期不能手术的肝细胞癌患者。这一突破性疗法授予是基于1b期临床试验KEYNOTE-524/Study 116的中期结果,其结果在2019年4月在美国癌症年会(the American Association for Cancer Research AACR)上曾发布。
之前的两个突破性疗法分别是仑伐替尼+K药用于晚期治疗晚期肾癌和晚期子宫内膜癌。这个突破性疗法的授予,是对于仑伐替尼+K药联合使用疗效和安全性上的肯定,同时也是对晚期肝癌这一生存时间非常短的指征选择上的肯定。需要注意的是,仑伐替尼+K药联合使用一线治疗肝细胞癌尚未得到美国FDA的最终批准,后续临床试验正在进行中。
揭开面纱,KEYNOTE-524/Study 1b期临床试验的疗效和安全性如何?
图1是临床试验的设计,入组共30例患者,男性患者(n=25),大部分为亚洲患者(n=23),为晚期不可切除的HCC患者,要求患者的BCLC分级为B(不适合TACE治疗)或C级,Child-Pugh分类为A类,ECOG PS 0~1分。入组的患者接受乐伐替尼12mg(体重≥60kg)或8mg(体重<60kg)口服,每天1次;联合帕博利珠单抗200mg,静脉用药,每3周1次。
下面的图1为临床试验的有效性和安全性,数据相当亮眼。研究者和独立第三方影像学评估结果:CR分别为3.3%和10%,ORR分别为36.7%和50%,DCR分别为96.7%和93.3%。中位PFS(无进展生存期)为9.7个月,6个月生存率和12个月生存率分别为83.3%和59.8%。
通俗讲,就是30个晚期肝细胞癌患者中,联合使用仑伐替尼+K药,按照不同的两组专家评估,肿瘤完全消失的患者人数分别为1人(3.3%)和3人(10%),肿瘤缩小30%以上的人数分别为11人(36.7%)和15人(50%),肿瘤完全控制住的患者分别为29人(96.7%)和28人(93.3%)。
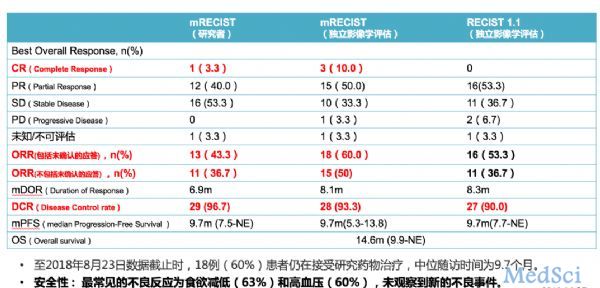

图1 1b期临床试验的安全性和有效性(图由作者整理)
对于晚期肝癌患者来说,这样的结果是非常令人振奋的。相信未来随着临床试验的数据不断更新,会对两者药物联合使用安全性和有效性会有更深入的认识,这将会是所有肝细胞癌患者的福音。
什么是肝细胞癌?
肝细胞癌是肝脏中最常见的恶性肿瘤,约为原发性肝癌的90%,5年生存率仅为18%,肿瘤的分期决定了治疗方案的选择。根治性方案有手术肝肿瘤切除或肝移植,通常能采用这类方案的多为相对早期的患者。不能手术切除的肝细胞癌预后很差,中位生存时间不超过1年。不幸的是,60-70%的患者在发现肿瘤时已失去手术、射频或肝移植机会,对于这些患者,能选择的治疗手段会非常有限。
药物简介
仑伐替尼(LENVIMA? lenvatinib),由日本卫材(Eisai)公司生产的,多激酶抑制剂,主要抑制的靶点为VEGFR 1-3, FGFR 1-4, PDGFRα, RET, and KIT。在三期临床试验Reflect中,总体生存率相对于索拉非尼为确认性非劣性,简单来说就是不比索拉非尼差,实际上在ORR数据上的优势是非常明显的,OS的数据比索拉非尼稍好。
Pembrolizumab(KEYTRUDA? pembrolizumab) ,俗称K药,是抗pd-1的单克隆抗体,由Merck生产,目前已批准用于肝细胞癌的二线治疗。