BEACON碧康制药
由欧洲财团参与投资,南亚地区唯一执行欧盟技术规范的上市制药企业,产品符合欧洲药典和美国药典标准。
肝癌,是人们心中最臭名昭著的癌症之一。
它的恶性程度高,进展速度快,而且早期症状不明显,导致约七成患者在被确诊时已无法接受切除、消融或移植等治疗。临床亟需一种应对晚期肝癌的解决办法。
昨日,默沙东与卫材联合宣布,双方合作开发的PD-1单抗可瑞达(pembrolizumab,帕博利珠单抗,俗称K药)联合靶向药乐卫玛(lenvatinib,乐伐替尼)的组合疗法,已获美国FDA突破性疗法资格,用于一线治疗不适合局部区域治疗的晚期不可切除性肝细胞癌患者。

这意味着,这项客观缓解率50%,疾病控制率93.3%的免疫+靶向疗法(下面会详细说明),将获得FDA的“加急审批”,以最快的速度和广大患者见面。
本次突破性疗法资格的认定,是基于一项Ib期临床研究——KEYNOTE-524/Study 116研究的中期分析数据。
试验设计
试验共入组了30例不可切除的肝细胞癌(HCC)患者,要求Child-Pugh分类为A类。其中多数患者为晚期(BCLC分期C期21例,B期9例);多数患者为亚裔(23例);多数患者为男性(25例)。
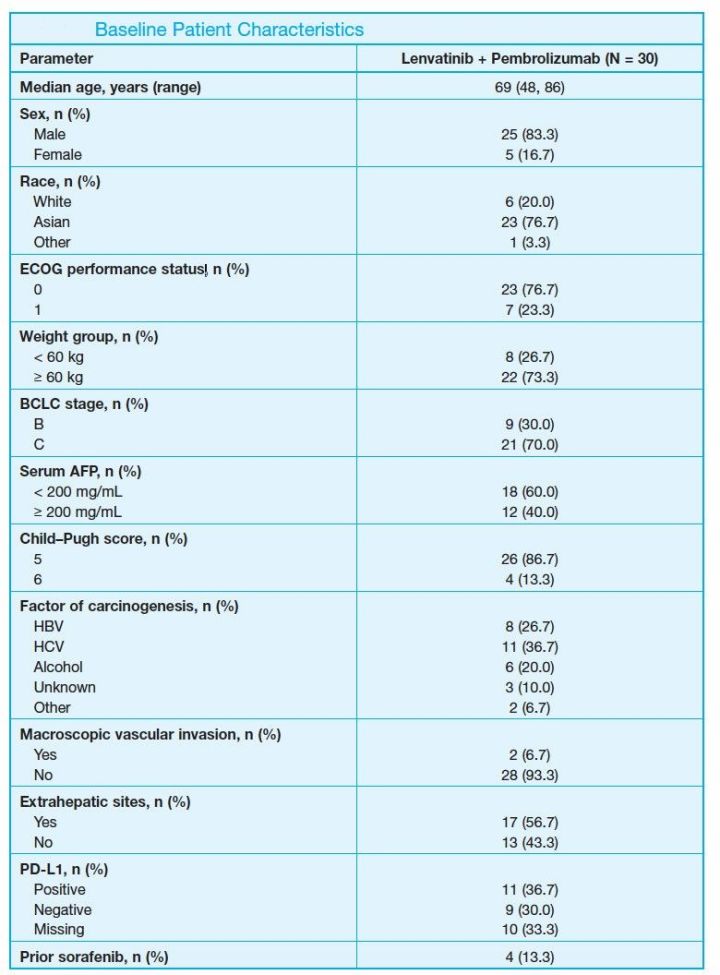
患者接受乐伐替尼12mg(体重≥60kg)或8mg(体重<60kg)口服,每天1次;联合帕博利珠单抗200mg,静脉用药,每3周1次。
试验结果
2018年8月23日数据截止时,18例(60%)患者仍在接受研究药物治疗,中位随访时间为9.7个月。
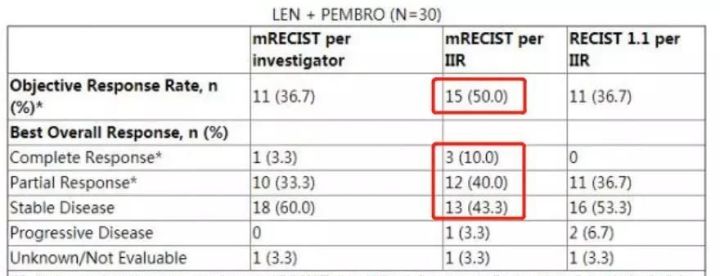
根据第三方独立评估委员会的评价标准,联合疗法的临床数据如下:
CR(完全缓解率,肿瘤完全消失并持续超过4周的患者占比):10.0%
PR(部分缓解率,肿瘤缩小超过50%,并持续超过4周的患者占比):40.0%
SD(疾病稳定率,肿瘤缩小不到50%或增大不到25%,并持续超过4周的患者占比):43.3%
ORR(客观缓解率,病情缓解的患者占比,CR+PR):50%
DCR(疾病控制率,病情不进展的患者占比,CR+PR+SD):93.3%
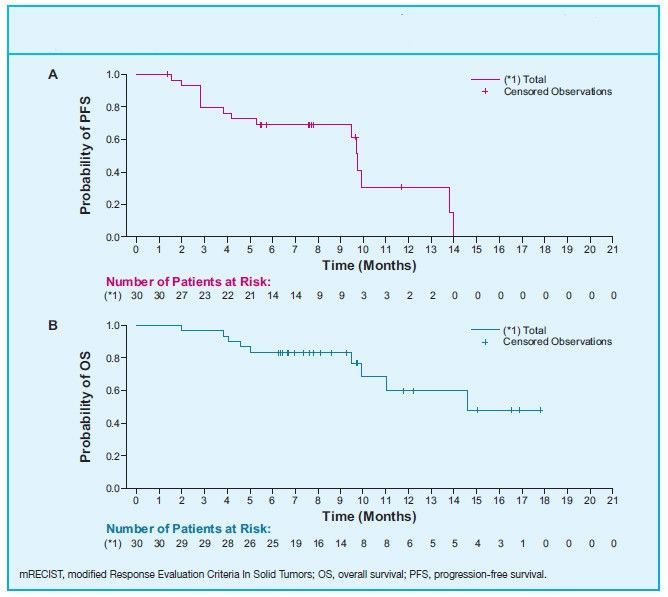
患者的中位PFS(无进展生存期)为9.7个月,6个月生存率和12个月生存率分别为83.3%和59.8%。
患者最常见的副作用包括食欲减退、高血压、腹泻和疲劳,未观察到新的不良反应。
总结
2018年9月在我国获批上市的靶向药乐伐替尼,以更高的缓解率、更长的疾病控制期,结束了索拉菲尼在肝癌临床十几年的统治地位;2018年7月上市的K药,更是炽手可热的抗癌明星,已获批十几种癌症的治疗,一旦起效,患者将获得长期生存的机会。
两药合作,肝癌控制率93.3%,客观缓解率50%,这样的数据,在近几十年的肝癌临床研究中可谓难能可贵,FDA授予其突破性疗法资格,也是对这种“免疫+靶向”强强联手的新思路的认可。