摩根大通医疗健康年会(J.P. Morgan Healthcare Conference)刚过,业内就迎来了一条重磅好消息。阿斯利康(AstraZeneca)与默沙东(MSD)今日宣布,美国FDA扩大了Lynparza(olaparib)的使用范围,治疗具有或疑似具有种系BRCA突变(gBRCAm)、人类表皮生长因子受体2(HER2)阴性、并曾接受过化疗的转移性乳腺癌患者,这些患者曾接受过化疗。如果患者的激素受体(HR)为阳性,则应事先接受内分泌治疗,或被认为不适合进行内分泌治疗。
值得一提的是,这是首个获批用于治疗乳腺癌的PARP抑制剂,也是首个获批治疗具有BRCA基因突变的转移性乳腺癌患者的药物。

乳腺癌是美国最常见的癌症形式。据美国国家癌症研究所(NCI)估计,今年约有252710名女性被诊断为乳腺癌,其中40610人将死于该病。大约20%-25%的遗传性乳腺癌患者和5%-10%的任何类型的乳腺癌患者都有BRCA突变。BRCA基因参与修复受损的DNA,防止肿瘤发展。然而,这些基因的突变可能导致包括乳腺癌在内的某些癌症。这些患者需要一款针对性的药物。
Lynparza就是这样一款药物。作为一款PARP(多聚ADP-核糖聚合酶)抑制剂,它可以进一步阻断参与修复受损DNA的PARP酶,使具有受损BRCA基因的癌细胞内的DNA突变积重难返,从而导致细胞死亡,减缓或阻止肿瘤生长。Lynparza在2014年首次被FDA批准用于治疗某些卵巢癌患者。
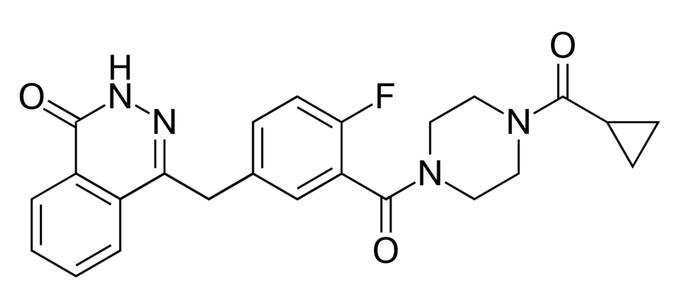
▲Olaparib的分子结构式(图片来源:维基百科)
Lynparza用于治疗乳腺癌的安全性和有效性在包含302位HER2阴性、伴有gBRCAm的转移性乳腺癌患者的随机临床试验中得到证实。该试验测量了治疗后肿瘤没有显著增长的时间(无进展生存期,PFS)。Lynparza组患者的中位PFS为7个月,而化疗组患者的中位PFS为4.2个月。疾病进展或死亡风险降低了42%(HR=0.58; 95%CI: 0.43-0.80; P=0.0009)。Lynparza组患者的客观缓解率为52%(95%CI: 44-60),相当于化疗组患者的两倍(23%)(95%CI: 13-35)。此外,Lynparza组患者的完全缓解率为7.8%,化疗组为1.5%。
“这类药物已被用于治疗BRCA突变的晚期卵巢癌,现在又显示出治疗某些类型的BRCA突变的乳腺癌的功效,”FDA药物评估和研究中心血液学和肿瘤学产品办公室代理主任兼FDA肿瘤卓越中心主任Richard Pazdur博士说:“这项批准证明了目前开发针对癌症潜在遗传原因的药物的范例,这通常跨越多种癌症类型。”
默沙东研究实验室首席医学官、高级副总裁兼全球临床开发主管Roy Baynes博士表示:“这项对Lynparza的扩大批准代表了对带有BRCA突变、HER2阴性的转移性乳腺癌患者的一个重要进步。此外,这一批准进一步推动了我们与阿斯利康在开发癌症治疗方面的重要合作。”
宾夕法尼亚大学Abramson癌症中心的BRCA Basser研究中心执行主任兼OlympiAD试验领导人的Susan M. Domchek博士表示:“诊断为BRCA突变相关转移性乳腺癌的患者通常比其它乳腺癌患者要年轻,且她们的疾病通常更具侵袭性、更加难治。虽然目前还没有治愈转移性乳腺癌的方法,但是今天的批准提供了一个新的有针对性的选择,可能有助于延缓这些患者的疾病进展。”
我们期待此次Lynparza扩大适应症的批准能帮助更多罹患乳腺癌的女性。
参考资料:
[1] FDA approves first treatment for breast cancer with a certain inherited genetic mutation
[2] LYNPARZA® (olaparib) Approved by US FDA in Germline BRCA-Mutated Metastatic Breast Cancer