上周,美国生物技术巨头吉利德(Gilead)开发的抗病毒药物Vemlidy(tenofovir alafenamide,TAF,25mg)获得美国食品和药物管理局(FDA)批准,用于慢性乙型肝炎(HBV)成人感染者的治疗。
而就在最近,Vemlidy在欧洲监管方面也传来了喜讯,欧洲药品管理局(EMA)人用医药产品委员会(CHMP)支持批准Vemlidy,用于慢性乙型肝炎成人感染者以及年龄≥12岁且体重≥35公斤的青少年感染者的治疗。欧盟委员会(EC)在做出最终审查决定时通常都会采纳CHMP的建议,也就是说,Vemlidy(TAF)极有可能在未来2-3个月获批在欧盟上市。
这也意味着,Vemlidy(TAF)将很快在美国和欧盟2大市场上市,该药将为乙肝患者提供一种安全性大幅改善的治疗方案,将促进乙肝(HBV)患者的长期护理。
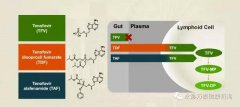
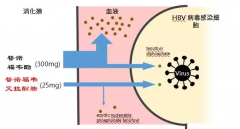
Vemlidy(TAF,替诺福韦艾拉酚胺富马酸)是一种新型核苷类逆转录酶抑制剂(NRTI),该药是吉利德已上市药物Viread(替诺福韦酯,TDF)的升级版。在临床试验中,TAF已被证明在低于Viread十分之一剂量时,就具有非常高的抗病毒疗效,同时具有更好的安全性,可改善肾功能和骨骼安全参数。