研究者Seth Rubin教授表示,这项研究中,我们对帕博西尼相互作用的蛋白质的特殊结构进行了研究,理解特定癌症对帕博西尼产生耐药性以及为何乳腺癌细胞会产生耐药性非常重要,这或许能帮助解释该药物的作用机制,并帮助科学家们思考重新开发能够克服药物耐受性的新型药物疗法。
文章中,研究人员重点对名为CDK4的蛋白进行研究,CDK4是一种细胞周期蛋白依赖性激酶,其能通过与失活视网膜母细胞瘤蛋白质(Rb,retinoblastoma protein)的其它蛋白配对来驱动细胞增殖,Rb是一种分子守卫,当其处于活性状态时能够有效阻断细胞进入到细胞生长和分裂环节。
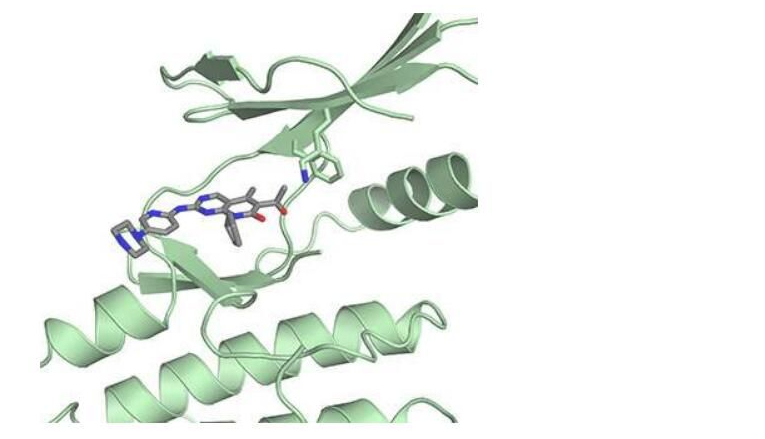
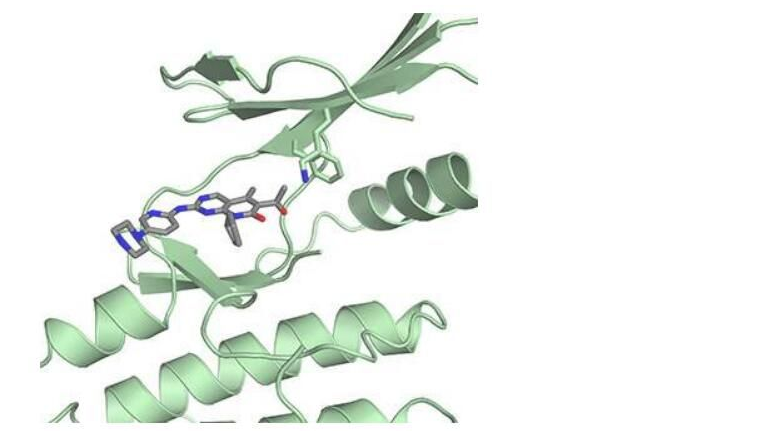
帕博西尼、其相关药物瑞博西尼(Ribociclib)和abemaciclib能够靶向作用CDK4并阻断其失活Rb,这些药物是通过测试纯化的CDK4复合物及激活CDK4的特殊蛋白而开发出来的,研究人员对一种名为p27的特殊蛋白非常感兴趣,其主要参与对CDK4的调节作用,随后研究人员确定了三种细胞中存在的蛋白结构,包括CDK4、细胞周期蛋白D和p27。
研究者Rubin指出,当我们利用p27来解析结构时意外地发现,其似乎无法与之结合,随后我们进一步检测后发现,这种药物似乎并不能结合并失活携带p27的蛋白复合物;使用乳腺癌细胞进一步研究或许能为阐明该药物的实际作用提供更多的线索,研究结果表明,帕博西尼能与CDK4单独结合,并抑制其与细胞周期蛋白D和p27形成活性复合体,这或许就会抑制另外一种不同的细胞周期依赖性激酶CDK2,从而阻断其失活Rb。
最后研究者解释道,药物帕博西尼不仅能抑制CDK4的组装,还能够间接抑制CDK2的功能,当癌细胞产生耐药性时,通常是因为其开始开启CDK2的活性。