原发中枢神经系统淋巴瘤(PCNSL)是临床少见的非霍奇金淋巴瘤(NHL),在NHL中占2%~3%,在所有结外型淋巴瘤中占4%~6%[1]。PCNSL预后较差,未经治疗患者的中位总生存(OS)期仅为1.5~3个月[2]。PCNSL主要侵犯脑、脊髓、脑脊膜、眼等部位,肿瘤细胞在组织内呈多中心生长[3]。PCNSL的病理类型多数为ABC表型弥漫大B细胞淋巴瘤(DLBCL),少数为生发中心B细胞(GCB)表型[4],较罕见的病理类型为Burkitt淋巴瘤及T细胞淋巴瘤[5]。目前,PCNSL的主要治疗方案为大剂量甲氨蝶呤(HD-MTX)为基础的化疗及全脑放疗[6]。HD-MTX单药治疗PCNSL患者的平均无进展生存(PFS)期为12个月,HD-MTX联合全脑放疗可将PFS延长至24个月[7],但全脑放疗的神经毒性限制了这一方案的运用[8]。相较于DLBCL,PCNSL的预后较差,5年OS率为29.9%[9]。近年来,BCR通路分子特异性靶向药物的突破性进展给这类患者带来新的治疗方案,其中第一代BTK抑制剂伊布替尼(ibrutinib)主要用于治疗慢性淋巴细胞白血病(CLL)和套细胞淋巴瘤(MCL)。本文主要分析伊布替尼在PCNSL中的作用机制及临床应用。
一、伊布替尼的作用机制及药代动力学
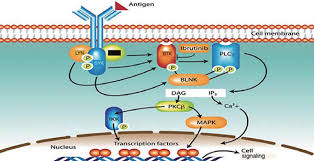
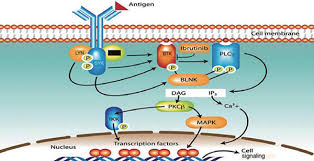
伊布替尼是一类小分子抑制剂,能与Bruton酪氨酸激酶(BTK)的活性位点Cys-481高效结合,降低其活化[10]。BTK为Tec激酶家族成员之一,在B细胞的BCR信号通路中有着重要的作用[11]–[12]。伊布替尼在抑制BTK的同时,还可以抑制或下调BTK相关的下游信号分子[13],并可能参与肿瘤微环境的调节、下调细胞炎症因子的表达[14]、阻断肿瘤细胞与微环境中的促生长及增殖因子的持续性接触[15]。同时,伊布替尼可对其他免疫细胞及激酶造成影响,诱导CD4+ T细胞向辅助性T细胞(Th1)分化,增强肿瘤的免疫监视[16]。口服后可在1~2 h内达到最大血药浓度,4 h后与95%以上的BTK活性结合位点不可逆结合[17]–[18]。
伊布替尼对于中枢神经系统淋巴瘤的疗效取决于颅内血药浓度[19]。由于血脑屏障的上皮细胞间存在紧密连接,表达在室管膜上多种特异性的转运蛋白将药物从上皮细胞逆转运到外周血循环中,降低多种药物在中枢神经系统中的生物活性[20]–[21]。作为蛋白转运体底物之一的伊布替尼,透过血脑屏障的能力非常有限。动物模型及临床试验皆证实颅脑中伊布替尼的血药浓度可达到体外实验的半数有效浓度(IC50)[19]。Bernard等[22]于2014年首次报道了3例合并中枢神经系统侵犯的MCL患者,伊布替尼560 mg/d单药口服治疗后脑脊液浓度从第8天至第36天稳定于1~3 µg/L。15例接受伊布替尼治疗的患者,在两周期化疗的第28天,给药后2 h脑脊液平均伊布替尼血药浓度为3.105 µg/L,口服560、840 mg/d组平均血药浓度分别为1.553、3.992 µg/L[23],提示840 mg/d剂量伊布替尼可能更适用于中枢神经系统侵犯的患者。
复发/难治PCNSL患者和系统性淋巴瘤累及中枢神经系统的患者可能存在不同程度的血脑屏障破坏,伊布替尼的血脑屏障穿透能力与初治PCNSL患者可能存在差异。在口服相同剂量的伊布替尼时,不同患者脑脊液及脑组织内浓度的差异可能导致不同的治疗结果。目前尚无含伊布替尼化疗方案一线治疗PCNSL的相关报道,亦无不同类型中枢神经系统淋巴瘤患者伊布替尼脑脊液浓度或血药浓度研究结果。Lionakis等[24]纳入5例初治PCNSL患者及13例复发/难治PCNSL患者,700、840 mg/d剂量伊布替尼组血浆和脑脊液的最大浓度(Cmax)和曲线下面积(AUC)未成比例增加;在560、700、840 mg/d剂量组,脑脊液/血浆渗透比例分别为1.20%(0.48%~4.10%)、0.94%(0.65%~2.07%)、0.78%(0.62%~1.25%)。
二、伊布替尼在PCNSL的应用机制
临床队列研究证实,在复发/难治PCNSL中,BCR信号轴的MYD88、CD79B为高频突变,CARD11、TNFAIP3为低频突变[25]。BCR信号通路的激活与MYD88、CD79B突变相关。同时MYD88突变也可导致Toll样受体信号通路(TLR)的的持续性激活。TLR与BCR共同激活将会导致NF-κB信号分子的大量表达[26]。不同组织部位发生的ABC亚型DLBCL的MYD88及CD79B突变丰度具有显著性差异,原发于免疫豁免区域的ABC亚型DLBCL有着更高突变丰度。其中MYD88、CD79B突变丰度在原发于中枢神经系统及睾丸的ABC亚型DLBCL中分别为75%、71%,在原发于淋巴结、消化道的患者中分别为17%、11%。MYD88、CD79B突变同样也发生在GCB亚型DLBCL,但检出率低于ABC亚型的DLBCL[27]。MUM1为NF-κB信号通路的转录下游分子[28],70%~95%的PCNSL病理标本可检出MUM1表达阳性,进一步证实了BCR信号轴异常激活所致NF-κB蛋白过量表达引起的一系列细胞增殖及凋亡变化是PCNSL疾病进展的分子病理基础。
三、伊布替尼单药治疗PCNSL
法国LYSA研究组开展一项多中心、单臂、Ⅱ期临床研究,应用伊布替尼单药(560 mg/d)治疗52例复发/难治PCNSL及原发性玻璃体视网膜淋巴瘤[29],两周期伊布替尼单药治疗的完全缓解(CR)、部分缓解(PR)、疾病稳定(SD)、疾病进展(PD)率分别为19%(10/52)、33%(17/52)、10%(5/52)、38%(20/52),中位PFS、OS期分别为3.3、14.4个月。Grommes等[28]在伊布替尼单药、剂量递增的Ⅰ期临床试验中纳入13例PCNSL患者,CR率为38%(5/13),中位PFS、OS期分别为4.6、15.0个月。有证据表明ABC亚型DLBCL的主要分子病理机制为BCR信号通路的过度激活,Wilson等[30]开展了伊布替尼单药治疗复发/难治DLBCL的Ⅰ、Ⅱ期临床研究,ABC亚型DLBCL组的CR率及PR率之和为37%(14/38),中位PFS、OS期分别为2.0、10.3个月;而GCB亚型的DLBCL中,CR率及PR率之和仅为5%(1/20),中位PFS、OS期分别为1.3、3.4个月。上述结果提示伊布替尼单药治疗中枢神经系淋巴瘤比系统性DLBCL有着更好的疗效,可能与PCNSL病理类型中非GCB型占大多数有关。上述结论尚待进一步研究证实。
四、伊布替尼与多药联合治疗PCNSL
1.伊布替尼联合MTX、利妥昔单抗化疗方案:MTX为抗叶酸类抗肿瘤药,抑制二氢叶酸还原酶(DHFR)并最终抑制嘌呤合成,在S期阻断复制增值活跃的细胞。除了抗肿瘤活性,低剂量MTX可应用于自身免疫性疾病,具有抗炎及免疫抑制作用,MTX可阻断5-氨基咪唑-4-羧胺核糖核酸转化酶(ATIC),该酶可将5-氨基咪唑-4-羧胺核糖核酸(AICAR)转化为甲酰基-AICAR(FAICAR)。AICAR可诱导腺嘌呤核苷酸释放到胞外空间,并将其转换为腺苷[31],而腺苷则被认为是MTX治疗类风湿性关节炎的关键分子[32],在使用肿瘤细胞坏死因子刺激的Jurkat细胞(人急性T淋巴细胞白血病细胞株)中的体外实验中,MTX诱导产生的腺苷抑制IkBα降解和IkBα的磷酸化,从而抑制NF-κB的表达[33]。HD-MTX作为PCNSL的常规化疗方案,MTX与伊布替尼联用是否通过NF-κB途径发挥作用有待进一步研究阐明。
由Grommes等[23]开展的以伊布替尼为基础的联合化疗方案治疗复发/难治中枢神经系统淋巴瘤的Ⅰb临床试验纳入15例患者(PCNSL 9例,继发性中枢神经系统淋巴瘤6例),HD-MTX联合560 mg/d伊布替尼、HD-MTX联合840 mg/d伊布替尼以及在上述两种方案基础上联用利妥昔单抗500 mg/m2,12例患者完成了诱导期的化疗,11例患者进入伊布替尼单药维持期(1例患者在4周期化疗后疾病进展而未行伊布替尼单药维持治疗),3例GCB亚型难治性患者未观察到治疗反应,试验整体的中位随访时间为19.7个月,8例获得CR,4例PR,1例SD,2例PD,总体反应率为80%。
2.伊布替尼联合DA-TEDDi-R化疗方案:Lionakis等[24]通过一系列不同浓度的伊布替尼与可潜在用于治疗PCNSL的化疗药物进行高通量筛选并提出DA-TEDDi-R化疗方案:替莫唑胺100 mg·m−2·d−1第2~5天,依托泊苷50 mg·m−2·d−1第2~5天,脂质体阿霉素50 mg/m2第2天,地塞米松10 mg·m−2·d−1第1~5天,阿糖胞苷70 mg第1、5天鞘内注射,在此基础上分别联用560、700、840 mg/d伊布替尼。所有患者在接受1个周期化疗前,接受2周“窗口期”伊布替尼单药治疗。该方案进行了概念验证的Ⅰb期临床试验,共纳入18例PCNSL患者,94%的患者在“窗口期”肿瘤负荷即获得降低、83%的患者获得PR,最终86%的患者获得CR,中位PFS期为15.3个月。
五、结语
PCNSL生物学行为及表观遗传特征研究的进展为靶向药物的研发及治疗方案提供新的策略。第一代BTK抑制剂伊布替尼得益于较好的脑脊液渗透浓度,在治疗中枢神经系统淋巴瘤中展现出有效的抗肿瘤效应,第二代BTK抑制剂Acalabrutinib、Zannbrutinib有着更强的靶向BTK共价能力,脱靶效应明显降低,从而带来更低的毒副作用[34]–[35],有望进一步改善中枢神经系统淋巴瘤患者的预后。