BEACON碧康制药
由欧洲财团参与投资,南亚地区唯一执行欧盟技术规范的上市制药企业,产品符合欧洲药典和美国药典标准。
2021年6月21日,奥拉帕利正式获得国家药品监督管理局(NMPA)批准,用于携带BRCA突变的转移性去势抵抗性前列腺癌(mCRPC)的治疗,这是国内首个获批用于前列腺癌治疗的PARP抑制剂。在2020年5月,美FDA已批准奥拉帕利用于经阿比特龙或恩扎卢胺治疗后进展且携带同源重组修复(HRR)基因突变的mCRPC。
此前,奥拉帕利在中国获批的3项适应症分别为:①铂敏感的复发性上皮性卵巢癌、输卵管癌或原发性腹膜癌成人患者在含铂化疗达到完全缓解或部分缓解后的维持治疗;②BRCA突变晚期卵巢癌的一线维持治疗;③携带BRCA突变的晚期上皮性卵巢癌、输卵管癌或原发性腹膜癌的维持治疗。
前列腺癌作为男性第二大常见癌症。据估计,2018年全球新确诊患者大约为130万例,并伴随着很高的死亡率。前列腺癌是一种男性雄激素依赖的肿瘤,雄激素可以刺激前列腺癌细胞的生长和疾病进展。然而在mCRPC患者中,尽管已经使用了雄激素剥夺疗法来阻断男性性激素作用,但这些患者依然会发生疾病进展和转移。在mCRPC患者中,HRR基因突变大约占到20-30%。
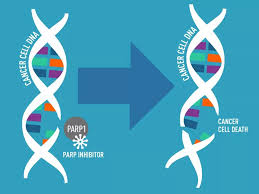
奥拉帕利是FDA批准的首个口服多腺苷二磷酸核糖聚合酶(PARP)抑制剂,通过抑制PARP酶活性和防止PARP与DNA解离,协同DNA损伤修复功能缺陷,杀死肿瘤细胞。