BEACON碧康制药
由欧洲财团参与投资,南亚地区唯一执行欧盟技术规范的上市制药企业,产品符合欧洲药典和美国药典标准。
美国FDA2017-4-29加速批准了武田制药Brigatinib(AP26113)上市,该药属于第二代ALK抑制剂,批准的适应症为:罹患间变性淋巴瘤激酶(ALK)阳性非小细胞肺癌,且在克唑替尼(crizotinib)治疗后病情出现进展或不耐受的患者。也就是说,这款新型靶向药,可以逆转克唑替尼耐药。
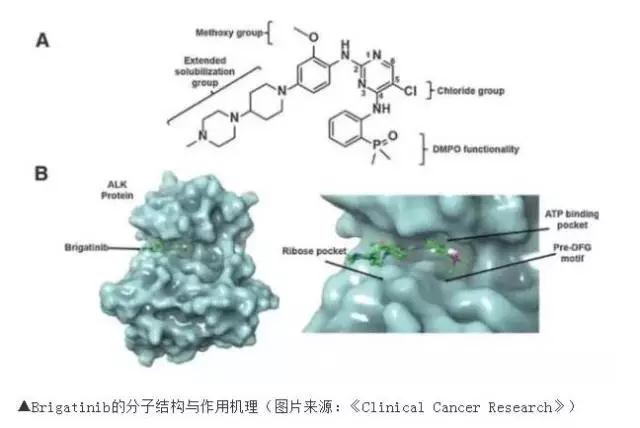
批准依据
Brigatinib对肺癌患者的治疗效果在一项中期临床试验中得到了检验。研究中,研究人员招募了222名晚期或转移性ALK阳性非小细胞肺癌患者,他们曾接受过crizotinib的治疗,但病情都出现了进展。在试验中,研究人员随机将患者分为两组:
第一组有112名患者,每日口服90毫克的Brigatinib(AP26113)。总体缓解率达到了48%(95% CI: 39%,58%),脑转移患者的总体缓解率为42%。
第二组有110名患者,每日口服90毫克的Brigatinib(AP26113),但是在一周后剂量上升至每日180毫克。总体缓解率为53%(95% CI:43%,62%),其中脑转移患者的总体缓解率为67%。
不良反应:
Brigatinib(AP26113)最常见的1-2级副作用是腹泻(20%)、乏力(22%)和恶心(33%),最常见的3-4级副作用是肺炎(7%),咳嗽(4%),呼吸困难(4%),缺氧(4%),胸水(4%)。安全性良好!
基于这些结果,美国FDA今日加速批准了brigatinib上市。
和其他ALK靶向药物相比,Brigatinib(AP26113)更优!
客观缓解率
Brigatinib(AP26113)的II期临床试验使用180mg剂量客观缓解率是54%,优于艾乐替尼(II期临床的客观缓解率是50%)和色瑞替尼(II期临床的客观缓解率是36%)。
中位生存期
方面Brigatinib(AP26113)是12.9个月,优于艾乐替尼的8.9个月,更显著优于色瑞替尼的5.7个月。对于脑转移患者而言,AP26113的颅内客观缓解率是67%,疾病控制率为86%,也优于入脑效果较好的艾乐替尼。
不良反应
不同ALK的靶点药物中,AP26113安全性最好,比较常见的是恶心、疲劳和腹泻等,有7%的概率存在肺炎。不良反应方面ALK的色瑞替尼是最厉害的,恶心和腹泻发生概率都分别高达80%多!
结论
二代ALK抑制剂,单独从ALK靶点的抑制效果看,AP26113相比艾乐替尼、色瑞替尼而言,不管是临床获益还是副作用等都具有明显的优势!
平台有话说:
Brigatinib(AP26113)可能是最好的ALK靶点药物!该药的批准上市,必定会给适应人群带来更大获益!